4 van 11
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 10:04
door Jan van de Velde
45) Over de oxidatietrap zijn de volgende beweringen juist:
- De alkalimetalen hebben in alle verbindingen de oxidatietrap -I.
- Waterstof heeft in alle verbindingen de oxidatietrap +I.
- De oxidatietrap van een element in een enkelvoudige stof is nul.
- De oxidatietrap van een element in een verbinding is de lading op het atoom van dat element in de verbinding.
Verborgen inhoud
Antwoord C.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 10:05
door Jan van de Velde
46) Welk van de volgende zwavelbevattende anionen kan niet, naargelang de omstandigheden, optreden en als oxidator en als reductor?
\(\mbox{SO}_4^{2-}\)
\(\mbox{SO}_3^{2-}\)
\(\mbox{S}^{2-}\)
\(\mbox{S}_2\mbox{O}_3^{2-}\)
[/b][/i]
Verborgen inhoud
Antwoord C.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 10:06
door Jan van de Velde
47) Je voegt 25,0 mL van een 0,10 M kaliumpermanganaatoplossing bij een overmaat kaliumjodide in zuur milieu. Het vrijgemaakte dijood reageert met exact 25,0 mL van een thiosulfaatoplossing. De deelreacties staan hieronder:
\(\mbox{MnO}_4^{-} + 8\ \mbox{H}^+ + 5\ e^- \longrightarrow \mbox{Mn}^{2+} + 8\ \mbox{H}_2\mbox{O}\)
\(2\ \mbox{I}^{-} - 2\ e^- \longrightarrow \mbox{I}_2\)
\(2\ \mbox{S}_2\mbox{O}_3^{2-} - 2\ e^- \longrightarrow \mbox{S}_4\mbox{O}_6^{2-}\)
De concentratie van de thiosulfaatoplossing is dan:
- 0,10 M
- 0,25 M
- 0,40 M
- 0,50 M
[/i]
Verborgen inhoud
Antwoord D.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 10:06
door Jan van de Velde
48) \(\mbox{H}_2(g) + \frac12\ \mbox{O}_2(g) \longrightarrow \mbox{H}_2\mbox{O}(vl) \qquad \Delta H = -256\ \mbox{kJ}\cdot\mbox{mol}^{-1}\)
Als je waterstof en zuurstof mengt bij kamertemperatuur, krijg je geen reactie, want:
- de reactie is endotherm.
- de evenwichtsconstante van deze reactie is klein.
- de activeringsenergie van deze reactie is hoog.
- de omgekeerde reactie gaat sneller dan de rechtstreekse reactie.
[/i]
Verborgen inhoud
Antwoord C.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 10:07
door Jan van de Velde
49) De snelheidsvergelijking van de ontbinding van waterstofperoxide is van de eerste orde ten opzichte van \(\mbox{H}_2\mbox{O}_2\). Welk van de volgende grafieken toont dit aan?
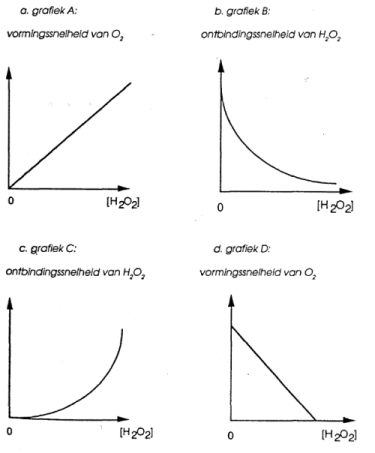
- grafiek a
- grafiek b
- grafiek c
- grafiek d
Verborgen inhoud
Antwoord A.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 10:58
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
50) In welke onderstaande reeks is het oxidatiegetal bij eenzelfde element in de reeks steeds hetzelfde?
\(\mbox{CrO}_3\)
, \(\mbox{CrF}_6\)
, \(\mbox{CrO}_4^{2-}\)
, \(\mbox{CrO}_2^-\)
\(\mbox{CO}_2\)
, \(\mbox{PbO}_2\)
, \(\mbox{H}_2\mbox{O}_2\)
, \(\mbox{Fe}_2\mbox{O}_3\)
\(\mbox{KClO}_3\)
, \(\mbox{Ca(ClO)}_2\)
, \(\mbox{Cl}_2\mbox{O}\)
, \(\mbox{HCl}\)
\(\mbox{HgCl}_2\)
, \(\mbox{HgSO}_4\)
, \(\mbox{HgI}_4^{2-}\)
, \(\mbox{Hg(NO}_3)_2\)
[/b][/i]
Verborgen inhoud
Antwoord D.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 10:59
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
51) 11,2 gram ijzer wordt met 6,40 g dizuurstof verbrand tot ijzer(III)oxide. Hoeveel gram ijzer(III)oxide kan je hierbij maximaal bekomen?
- 16,0 gram
- 17,6 gram
- 21,3 gram
- 32,0 gram
Verborgen inhoud
Antwoord A.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 11:00
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
52) Het gas HI ontbindt bij hoge temperatuur gedeeltelijk in de gassen H2 en I2. Indien men start met een beginhoeveelheid HI van 4,0 mol in een reactievat van 5,0 liter en men houdt bij evenwicht 2,5 mol HI over, dan is de evenwichtsconcentratie van het gas I2:
- 0,15 M
- 0,25 M
- 0,30 M
- 0,50 M
Verborgen inhoud
Antwoord A.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 11:01
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
53) Bij dezelfde omstandigheden zal 22 gram van het gas koolstofdioxide hetzelfde volume hebben als 22 gram van de volgende gasvormige stof:
- zwaveldioxide
- distikstofoxide
- koolstofmonoxide
- stikstofdioxide
Verborgen inhoud
Antwoord B.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 11:02
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
54) In een verdunde oplossing ioniseert NaOH volledig. Door 10 ml NaOH-oplossing 0,20 M aan te lengen tot 1,0 liter bekomt men een oplossing X. Welke van de onderstaande beweringen over oplossing X is juist?
- [OH-] = 0,20 M
- pOH = 1,7
- pH = 10,3
- 80 mg NaOH werd opgelost
Verborgen inhoud
Antwoord D.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 11:02
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
55) Het element broom komt in de natuur voor als een mengsel van twee isotopen, één met 44 neutronen in de kern en één met 46 neutronen. Welk van onderstaande beweringen is fout?
- Het massagetal komt overeen met de som van het aantal protonen en het aantal neutronen.
- Natuurlijk broom bevat evenveel van beide isotopen.
- Een neutraal atoom van het broomisotoop met 44 neutronen bevat 36 elektronen.
- Een bromide-ion bevat meer elektronen dan het broomatoom met 44 neutronen.
Verborgen inhoud
Antwoord C.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 11:03
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
56) Stel dat je in een waterige oplossing in standaardomstandigheden \(\mbox{Co}^{3+}\), \(\mbox{Co}^{2+}\), \(\mbox{Sn}^{4+}\) en \(\mbox{Sn}^{2+}\)-ionen hebt. Van alle ionen is de concentratie 1,0 M. Gegeven wordt de standaardreductiepotentiaal van het koppel \(\mbox{Co}^{3+} / \mbox{Co}^{2+}\) = 1,81 V en voor het koppel \(\mbox{Sn}^{4+} / \mbox{Sn}^{2+}\) = 0,15 V. Welke van de volgende reacties verwacht je?
\(2\ \mbox{Co}^{3+} + \mbox{Sn}^{2+} \longrightarrow 2\ \mbox{Co}^{2+} + \mbox{Sn}^{4+}\)
\(\mbox{Co}^{3+} + \mbox{Sn}^{2+} \longrightarrow \mbox{Co}^{2+} + \mbox{Sn}^{4+}\)
\(2\ \mbox{Co}^{2+} + \mbox{Sn}^{4+} \longrightarrow 2\ \mbox{Co}^{3+} + \mbox{Sn}^{2+}\)
\(2\ \mbox{Co}^{3+} + \mbox{Sn}^{4+} \longrightarrow 2\ \mbox{Co}^{2+} + \mbox{Sn}^{2+}\)
[/b][/i]
Verborgen inhoud
Antwoord A.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 11:04
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
57) Gegeven de moleculen \(\mbox{CO}_2\), \(\mbox{SO}_2\), \(\mbox{NH}_3\) en \(\mbox{CH}_4\). Volgende moleculen zijn polaire moleculen:
- enkel
\(\mbox{CO}_2\)
- enkel
\(\mbox{SO}_2\)
\(\mbox{SO}_2\)
en \(\mbox{NH}_3\)
\(\mbox{CO}_2\)
en \(\mbox{CH}_4\)
[/b][/i]
Verborgen inhoud
Antwoord C.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 11:05
door Jan van de Velde
(Herkomst: simulatie-examen EMSA 2009)
58) Het dichromaation is een sterke oxidator. Hierdoor zal een waterige oplossing van dichromaationen in zuur midden reageren met \(\mbox{Fe}^{2+}\)-ionen in een aflopende reactie:
\(\mbox{Cr}_2\mbox{O}_7^{2-} + 6\ \mbox{Fe}^{2+} + 14\ \mbox{H}^+ \longrightarrow 2\ \mbox{Cr}^{3+} + 6\ \mbox{Fe}^{3+} + 7\ \mbox{H}_2\mbox{O}\)
Stel dat je in deze reactie start vanuit een waterige oplossing met 0,10 mol dichromaationen, 0,30 mol
\(\mbox{Fe}^{2+}\)-ionen en een overmaat
\(\mbox{H}^{+}\)-ionen. Welke van de volgende beweringen is dan correct?
- Alle dichromaationen worden verbruikt.
- Er wordt 0,10 mol
\(\mbox{Fe}^{2+}\)
verbruikt.
- Er wordt 0,20 mol
\(\mbox{Cr}^{3+}\)
gevormd.
- De pH stijgt wanneer de reactie vordert.
[/b][/i]
Verborgen inhoud
Antwoord D.
Stel een vraag over deze oefening.
Re: Modelopgaven chemie voor toelatingsproef arts-tandarts
Geplaatst: za 11 jul 2009, 12:34
door Jan van de Velde
(Herkomst: onbekend, op dit forum inhoudelijk gecorrigeerd)
59) Men borrelt HCl-gas door 20 liter van een waterige NaOH-oplossing (25°C) met pH 12 tot de pH van de resulterende oplossing 11 bedraagt. Welk is het volume gas dat onder standaardvoorwaarden in de oplossing moet opgenomen worden?
- 0,4 L
- 2 L
- 4 L
- 20 L
Verborgen inhoud
Antwoord C.
Stel een vraag over deze oefening.
