Als water bevriest door verlaging van de temperatuur, dan zet het uit dit i.t.t. de andere vloeistoffen. De andere vloeistoffen die krimpen als ze vast worden. Mijn vraag is zijn er meer vloeistoffen die uitzetten als ze vast worden?
Ik zei net dat water vast wordt door velaging van de temperatuur, maar water kan ook vast worden bij extreem hoge drukken en hier gaat mijn 2e watervraag over. Stel ik ga water onder heel hoge druk zetten zo hoog dat het vast wordt, dan heb je een andere vorm van waterijs, met een dichtere structuur dan vloeibaar water. (Dat water niet samendrukbaar is, gaat alleen op bij normale drukken, bij extreem hoge drukken van duizenden bars is water wel degelijk een beetje samendrukbaar en hoe meer druk, hoe meer het samengedrukt wordt)
Goed door de heel hoge druk is water vast geworden. Ik weet dat dat kan, ik heb wel eens een grafiek gezien van ijs- water-stoom, bij verschillende temperaturen en drukken. Goed stel ik zet op water van kamertemperatuur een druk van 100.000bar(theoreties want ik heb geen materiaal om dat voor elkaar te krijgen), dan wordt het door de druk vast. Goed maar wat gebeurt er dan als ik de druk dan weer laat dalen? Wordt het water dan weer vloeibaar? Ik laat de temperatuur constant. Net zoals butaangas dat onder druk eerst vloeibaar is, maar als de druk wegvalt weer gas wordt.
En tenslotte een laatste watervraag. Stel als ik de druk zou blijven opvoeren (theoreties, want in elke cillinder waar ik een dergelijke druk zou willen opwekken zou kapot knappen, ongeacht hoe dik de wand mag zijn, maar dat even terzijde) wat zal er op den duur met het water gebeuren? Ik laat de temperatuur constant. Okee het zal eerst van vloeibaar naar vast gaan, en vervolgens zal ook de vaste stof verder gecomprimeerd worden. Maar wat gaat er met de watermoleculen gebeuren, ze bestaan uit 2 waterstof en 1 zuurstof atomen, worden de 3 atomen op den duur 1 atoom? En kan zoiets ook weer gewoon vloeibaar water worden als de druk weer normaal wordt?
Tenslotte wil ik ook nog een opmerking plaatsen, als je water afkoelt tot beneden het vriespunt dan zal het bevriezen bij 0*C, bij normale druk, maar ga ik de druk verhogen, dan zal de druk in eerste instantie voorkomen dat water bij 0*C bevriest, het zal dan een paar graden onder het vriespunt bevriezen. En zo kan ik nog door gaan met het opvoeren van de druk en het verlagen van de temperatuur. Toch is er een minimum temperatuur waarbij water onder hoge druk nog net vloeibaar kan zijn, dat is bij een temperatuur van -21,985*C (bijna -22*C) en de druk aldaar is maximaal 2099bar. Dat heb ik ergens gelezen. Bij hogere drukken en/of lagere temperaturen is water vast. Overgens wil ik erbij vermelden dat er 9 verschillende structuren zijn van waterijs, afhankelijk van druk en temperatuur.
Een watervraagje.
Moderator: physicalattraction
Forumregels
(Middelbare) school-achtige vragen naar het forum "Huiswerk en Practica" a.u.b.
Zie eerst de Huiswerkbijsluiter
(Middelbare) school-achtige vragen naar het forum "Huiswerk en Practica" a.u.b.
Zie eerst de Huiswerkbijsluiter
-
bats
- Artikelen: 0
- Berichten: 418
- Lid geworden op: za 29 mei 2004, 17:52
- Elmo
- Artikelen: 0
- Berichten: 3.437
- Lid geworden op: ma 27 okt 2003, 13:47
Re: Een watervraagje.
Er zijn inderdaad nog meer (slechts een paar) stoffen die ook uitzetten bij afnemende temperatuur. IJzer bijvoorbeeld.
Ter verduidelijking is hier het fase-diagram van water in de lage-druk limiet:
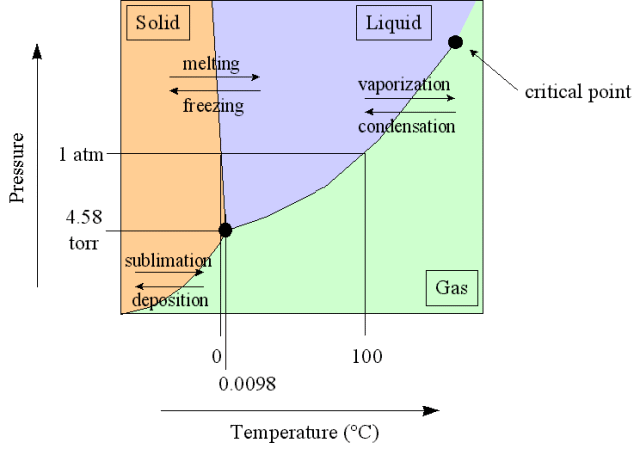
En hier voor wat hogere drukken:

Zoals je uit het fase-diagram kunt zien, zal vloeibaar water pas bij hele hoge druk vast worden: bij drukken boven de ~7 kbar zal vloeibaar water van 1 oC overgaan in vast ijs (type VI). Bij 'normale' drukken blijft het altijd vloeibaar. Als je de druk toch zo hoog maakt dat het vast wordt, en je laat de druk weer omlaag gaan, dan wordt het ijs ook weer gewoon vloeibaar water.
Ter verduidelijking is hier het fase-diagram van water in de lage-druk limiet:

En hier voor wat hogere drukken:

Zoals je uit het fase-diagram kunt zien, zal vloeibaar water pas bij hele hoge druk vast worden: bij drukken boven de ~7 kbar zal vloeibaar water van 1 oC overgaan in vast ijs (type VI). Bij 'normale' drukken blijft het altijd vloeibaar. Als je de druk toch zo hoog maakt dat het vast wordt, en je laat de druk weer omlaag gaan, dan wordt het ijs ook weer gewoon vloeibaar water.
Never underestimate the predictability of stupidity...
-
bats
- Artikelen: 0
- Berichten: 418
- Lid geworden op: za 29 mei 2004, 17:52
Re: Een watervraagje.
Bedankt voor het antwoord.
Maar stel dat ik de druk nog hoger maak, dus als water van 1*C al vast is bij ~7kbar (ijs 6) dan zal het vaste ijs(ijs6) ook verder samengedrukt worden, wat voor ijsvorm krijg je dan? En kan het gebeuren als ik de druk blijf opvoeren dat dan de watermoleculen die uit 3 atomen bestaan op den duur gaan fuseren tot 1 groot atoom?
En aan de hand van het antwoord dat water van 1*C bij drukken van 7kbar (=~7000bar) kan ik ook uitrekenen hoe diep een zee theoreties kan zijn hier op aarde, nl. als de druk op de zeebodem > 7000bar wordt wordt het water vast, dus dan is de zeebodem van vast waterijs(ijs6) en bij elke 10m stijgt de druk 1 bar, dus de maximale diepte is dan ongeveer 7000 X 10 = 70.000m ~70km is de theoreties maximale diepte. Bedankt nog, nu is mijn antwoord op de vraag of een zee theoreties 100 km diep kan zijn: Nee.
Maar stel dat ik de druk nog hoger maak, dus als water van 1*C al vast is bij ~7kbar (ijs 6) dan zal het vaste ijs(ijs6) ook verder samengedrukt worden, wat voor ijsvorm krijg je dan? En kan het gebeuren als ik de druk blijf opvoeren dat dan de watermoleculen die uit 3 atomen bestaan op den duur gaan fuseren tot 1 groot atoom?
En aan de hand van het antwoord dat water van 1*C bij drukken van 7kbar (=~7000bar) kan ik ook uitrekenen hoe diep een zee theoreties kan zijn hier op aarde, nl. als de druk op de zeebodem > 7000bar wordt wordt het water vast, dus dan is de zeebodem van vast waterijs(ijs6) en bij elke 10m stijgt de druk 1 bar, dus de maximale diepte is dan ongeveer 7000 X 10 = 70.000m ~70km is de theoreties maximale diepte. Bedankt nog, nu is mijn antwoord op de vraag of een zee theoreties 100 km diep kan zijn: Nee.
- Elmo
- Artikelen: 0
- Berichten: 3.437
- Lid geworden op: ma 27 okt 2003, 13:47
Re: Een watervraagje.
Over die zee van 100 km: ik denk dat het wel kan, want bovenstaand fase-diagram is voor zuiver water. Zeewater bevat een hoop zout (~3%) en heeft daardoor een beduidend lager vriespunt. Ik weet niet waar de fase-overgang voor zout water op de druk-as zou liggen, maar ik vermoed bij duidelijk hogere drukken.
Als je voor zuiver water van 1 oC de druk blijft verhogen, dan ga je van vloeibaar over naar ijs VI, en daarna naar ijs VII. Bij hogere drukken die experimenteel haalbaar zijn, blijf je bij ijs VII. In theorie, bij extreem extreem extreem veel hogere drukken zal je een andersoortige fase-overgang krijgen. Ik denk dat je dan moet denken aan neutronen-sterren of (uiteindelijk) een zwart gat. Maar, nogmaals, er is geen experiment op aarde waarin je dit kunt zien omdat deze drukken bij lange na niet haalbaar zijn.
Als je voor zuiver water van 1 oC de druk blijft verhogen, dan ga je van vloeibaar over naar ijs VI, en daarna naar ijs VII. Bij hogere drukken die experimenteel haalbaar zijn, blijf je bij ijs VII. In theorie, bij extreem extreem extreem veel hogere drukken zal je een andersoortige fase-overgang krijgen. Ik denk dat je dan moet denken aan neutronen-sterren of (uiteindelijk) een zwart gat. Maar, nogmaals, er is geen experiment op aarde waarin je dit kunt zien omdat deze drukken bij lange na niet haalbaar zijn.
Never underestimate the predictability of stupidity...
- JV
- Artikelen: 0
- Berichten: 91
- Lid geworden op: vr 10 sep 2004, 18:36
Re: Een watervraagje.
Naast het feit dat zeewater niet zuiver is, is het ook nog zo dat als de zee zo diep zou zijn, dat het daar beneden warmer is dan 1°C. Je zit immers veel dichter bij de aard kern. De bodem zal hierdoor warm zijn en dat zal langzaam omhoog trekken.nu is mijn antwoord op de vraag of een zee theoreties 100 km diep kan zijn: Nee.
Voor Suyver: zijn deze drukken niet haalbaar in tokomak centrales, waar ze kernfusie opgang proberen te krijgen. Ik heb begrepen dat daar de druk ook aardig kan oplopen. Zwart gat druk (hoeveel bar is dat eigenlijk?) zal je niet halen, maar het is wel genoeg om atomen te laten samensmelten
- Elmo
- Artikelen: 0
- Berichten: 3.437
- Lid geworden op: ma 27 okt 2003, 13:47
Re: Een watervraagje.
In een tokamak is de druk helemaal niet zo hoog: Typische plasma-dichtheden zijn meestal rond de 1020 - 1021 / m3, wat ruwweg 0.1 - 1 bar is. De temperatuur in de kern is wel heel erg hoog (~50 miljoen K). Het is ook onwaarschijnlijk dat je met magnetische opsluitingenen van orde 10 Tesla drukken van ~Mbar zou kunnen halen, daarvoor zijn de electrostatische repulsies veel te groot.
Never underestimate the predictability of stupidity...
- JV
- Artikelen: 0
- Berichten: 91
- Lid geworden op: vr 10 sep 2004, 18:36
Re: Een watervraagje.
[quote='"suyver"]In een tokamak is de druk helemaal niet zo hoog: Typische plasma-dichtheden zijn meestal rond de 1020 - 1021 / m3' date=' wat ruwweg 0.1 - 1 bar is. De temperatuur in de kern is wel heel erg hoog (~50 miljoen K).quote']
De gemiddelde druk in een tokamak zal inderdaad niet erg hoog zijn. Maar zeer lokaal, daar waar de atomen fuseren zal de druk toch aardig op moeten lopen, mede dankzij de enorm hoge temperatuur. Druk is niets anders dan het heel dicht op elkaar zitten dan moleculen. En als het tritium en deuterium niet heel dicht bijelkaar komen, valt er weinig te fuseren. Of heb ik iets niet begrepen?
De gemiddelde druk in een tokamak zal inderdaad niet erg hoog zijn. Maar zeer lokaal, daar waar de atomen fuseren zal de druk toch aardig op moeten lopen, mede dankzij de enorm hoge temperatuur. Druk is niets anders dan het heel dicht op elkaar zitten dan moleculen. En als het tritium en deuterium niet heel dicht bijelkaar komen, valt er weinig te fuseren. Of heb ik iets niet begrepen?
-
bats
- Artikelen: 0
- Berichten: 418
- Lid geworden op: za 29 mei 2004, 17:52
Re: Een watervraagje.
Nog bedankt voor het antwoord.
Over die zee die theoreties 100km diep zou zijn. Klopt, ik had inderdaad geen rekening gehouden met het feit van zout water, dat zout water onder hoge drukken zich ander zou gedragen. Maar ik ging er dan ook vanuit dat het een zee van zuiver water zou zijn. En ik ging ervan uit dat het water op die diepte een temperatuur van 1*C zou hebben, letwel allemaal theoreties.
Over het feit dat je bij 100 km diepte dichter bij de aardkern bent en dat de temperatuur daar hoger is dat klopt, maar water dat warmer is is lichter, dus dat stijgt op. En kouder water (bijv. 1*C) dat zinkt naar beneden, omdat dat zwaarder is. Je krijgt daar wel een stroming van water dat warm omhoog gaat en koud naar beneden.
Nou nog even een vraagje over ijs. Wat voor kleuren hebben al die verschillende ijsvormen bij die hoge drukken, of maakt dat totaal niets uit?
Over die zee die theoreties 100km diep zou zijn. Klopt, ik had inderdaad geen rekening gehouden met het feit van zout water, dat zout water onder hoge drukken zich ander zou gedragen. Maar ik ging er dan ook vanuit dat het een zee van zuiver water zou zijn. En ik ging ervan uit dat het water op die diepte een temperatuur van 1*C zou hebben, letwel allemaal theoreties.
Over het feit dat je bij 100 km diepte dichter bij de aardkern bent en dat de temperatuur daar hoger is dat klopt, maar water dat warmer is is lichter, dus dat stijgt op. En kouder water (bijv. 1*C) dat zinkt naar beneden, omdat dat zwaarder is. Je krijgt daar wel een stroming van water dat warm omhoog gaat en koud naar beneden.
Nou nog even een vraagje over ijs. Wat voor kleuren hebben al die verschillende ijsvormen bij die hoge drukken, of maakt dat totaal niets uit?
- JV
- Artikelen: 0
- Berichten: 91
- Lid geworden op: vr 10 sep 2004, 18:36
Re: Een watervraagje.
De kleur maakt niet zoveel uit. Ijs is een soort licht blauw. Dit komt omdat ijs rood licht absorbeert, en dus met name blauw licht weerkaatst. Dit effect wordt sterker naar mate het ijs dikker wordt. (IJs bergen hebben altijd een blauwe gloed over zich)