Hoe komt het dat een waterstofatoom maar 1electron heeft
en het spectrum toch meerdere spectraallijnen bevat?
Dank bij voorbaat!
-
vinny007
- Artikelen: 0
- Berichten: 89
- Lid geworden op: di 26 dec 2006, 11:45
-
Rudeoffline
- Artikelen: 0
- Berichten: 624
- Lid geworden op: di 06 dec 2005, 09:59
Re: Spectraallijnen van een waterstofatoom
Het spectrum van een atoom wordt bepaald door de energieniveaus van het atoom/molecuul. Een waterstof atoom heeft dan maar 1 elektron, maar dat elektron kan in verschillende energieniveaus zitten. Het emissiespectrum wordt bv bepaald door de overgang van het elektron van 1 energieniveau naar een lager energieniveau met energieverschil E, waarbij er een foton wordt uitgezonden. De frequentie van dat foton is natuurlijk gerelateerd aan E via E=h*f.vinny007 schreef:Hoe komt het dat een waterstofatoom maar 1electron heeft
en het spectrum toch meerdere spectraallijnen bevat?
Dank bij voorbaat!
Andersom wordt het absorptiespectrum bepaald door de overgang van het elektron van 1 energieniveau naar een hoger energieniveau, als het een foton opneemt.
Het feit dat zo'n atoom niet alle, maar alleen heel specifieke energieniveaus heeft wordt beschreven door de quantummechanica. Een elektron kan dus niet alle mogelijke energieën hebben, maar alleen heel bepaalde. Als het elektron alle mogelijke energieniveaus kon betrekken, dan had je in plaats van een paar lijnen in het emissiespectrum een continuüm aan lijnen gezien.
-
vinny007
- Artikelen: 0
- Berichten: 89
- Lid geworden op: di 26 dec 2006, 11:45
Re: Spectraallijnen van een waterstofatoom
Dus zou een waterstofatoom ook een X-straal kunnen uitzenden of niet?
-
Giulia
- Artikelen: 0
- Berichten: 69
- Lid geworden op: wo 17 jan 2007, 19:44
Re: Spectraallijnen van een waterstofatoom
Hoi!
Wat ik me hierover afvroeg: in het emissiespectrum van waterstof staan er een heleboel lijnen dicht bij elkaar bij een relatief korte golflengte (tov Halfa). Zijn die dan afkomstig van het elektron dat van slechts een paar schillen hoger terugvalt op de eerste? (omdat het elektron dicht bij de kern de hoogste potentiële energie heeft en dus bij terugvallen van kleine 'hoogte' dan de meeste energie afgeeft).
Alvast bedankt!
Julie
Wat ik me hierover afvroeg: in het emissiespectrum van waterstof staan er een heleboel lijnen dicht bij elkaar bij een relatief korte golflengte (tov Halfa). Zijn die dan afkomstig van het elektron dat van slechts een paar schillen hoger terugvalt op de eerste? (omdat het elektron dicht bij de kern de hoogste potentiële energie heeft en dus bij terugvallen van kleine 'hoogte' dan de meeste energie afgeeft).
Alvast bedankt!
Julie
- Jan van de Velde
- Moderator
- Artikelen: 0
- Berichten: 51.334
- Lid geworden op: di 11 okt 2005, 20:46
Re: Spectraallijnen van een waterstofatoom
Als ik je goed begrijp is het net andersom. Die lijnen die dicht bij elkaar staan is juist een "val" van een "hoge" baan naar een iets minder hoge. Kleine energieverschillen dus.
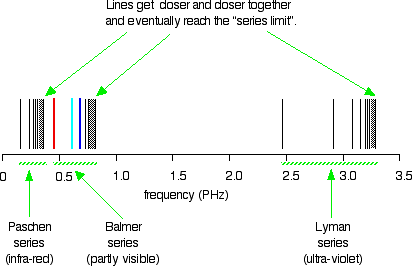
In de lyman serie zie je de hoogste frequenties en dus ook de grootste energieën.
Hier zie je dat voorgesteld in het Bohrmodel voor de Lymanserie (terugval naar n=1) en voor de Balmerserie (terugval naar n=2)
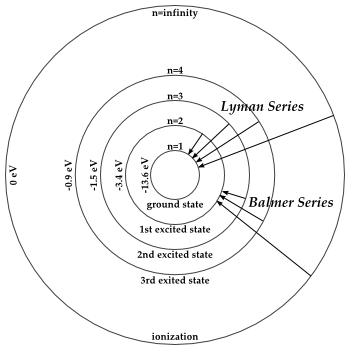

In de lyman serie zie je de hoogste frequenties en dus ook de grootste energieën.
Hier zie je dat voorgesteld in het Bohrmodel voor de Lymanserie (terugval naar n=1) en voor de Balmerserie (terugval naar n=2)

ALS WIJ JE GEHOLPEN HEBBEN...
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
- Jan van de Velde
- Moderator
- Artikelen: 0
- Berichten: 51.334
- Lid geworden op: di 11 okt 2005, 20:46
Re: Spectraallijnen van een waterstofatoom
Zeg ik het nóg fout....Als ik je goed begrijp is het net andersom. Die lijnen die dicht bij elkaar staan is juist een "val" van een "hoge" baan naar een iets minder hoge. Kleine energieverschillen dus.
Die dicht bij elkaar liggende lijnen ontstaan door "vallen" van dicht bij elkaar liggende energieniveaus naar het basisniveau van de serie.
ALS WIJ JE GEHOLPEN HEBBEN...
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
-
Giulia
- Artikelen: 0
- Berichten: 69
- Lid geworden op: wo 17 jan 2007, 19:44
Re: Spectraallijnen van een waterstofatoom
Dus, het is juist wat ik zei?
(Bedankt!)
(Bedankt!)
-
Giulia
- Artikelen: 0
- Berichten: 69
- Lid geworden op: wo 17 jan 2007, 19:44
Re: Spectraallijnen van een waterstofatoom
En is het eigenlijk mogelijk om emissiespectra te voorspellen of kan je dat alleen experimenteel bekomen? (vb van een atoom met meer elektronen, Li ofzo)
- eendavid
- Artikelen: 0
- Berichten: 3.751
- Lid geworden op: vr 15 sep 2006, 14:24
Re: Spectraallijnen van een waterstofatoom
Dat kan, maar de berekeningen moeten dan numeriek gebeuren (en de theorie daarrond is nogal technisch). De minst technische methode steunt op de Hartree-Fock benadering, waarover tonnen informatie online te vinden is.
- Jan van de Velde
- Moderator
- Artikelen: 0
- Berichten: 51.334
- Lid geworden op: di 11 okt 2005, 20:46
Re: Spectraallijnen van een waterstofatoom
Als ik je eerdere uitspraken:Giulia schreef:Dus, het is juist wat ik zei?
(Bedankt!)
goed begrijp, dan is wat ik daaruit begrijp niet juist. De lijnen van de elektronen die terugvallen van bijvoorbeeld n= 2 naar n=1 respectievelijk n=3 naar n=1 liggen ver uiteen. De lijnen van de elektronen die terugvallen van bijv n=9 naar n=1 resp n=8 naar n=1 liggen heel dicht op elkaar. De energieverschillen tussen n=9 en n=8 zijn betrekkelijk gering.Zijn die (dicht op elkaar ligende lijnen) dan afkomstig van het elektron dat van slechts een paar schillen hoger terugvalt op de eerste? (omdat het elektron dicht bij de kern de hoogste potentiële energie heeft en dus bij terugvallen van kleine 'hoogte' dan de meeste energie afgeeft).
Waar je dat ook al aan kan zien is dat álle lijnen van de Lyman-serie (terugval naar n=1) een veel hogere frequentie en dus energie hebben dan om het even welke lijn uit de Balmer-serie (terugval naar n=2) Het verschil tussen n=1 en n=2 bedraagt ruim 10 eV. Van n= 2 naar om het even welke andere lijn hoogstens 3,4 eV
ALS WIJ JE GEHOLPEN HEBBEN...
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
-
Giulia
- Artikelen: 0
- Berichten: 69
- Lid geworden op: wo 17 jan 2007, 19:44
Re: Spectraallijnen van een waterstofatoom
Ok, ik snap het! Bedankt!