Hallo iedereen!
Ik ben studente lerarenopleiding.
In mijn les moet ik kunnen verklaren wat het verschil is tussen het molecuulmodel en het atoommodel.
Helaas weet ik het antwoord er zelf niet op. Ik ken ze wel beide, maar ik kan het verschil niet zo snle aanduiden.
Kan iemand me misschien hierbij helpen?
bedankt !
Molecuulmodel vs atoommodel
Moderator: ArcherBarry
- Elena
- Artikelen: 0
- Berichten: 77
- Lid geworden op: ma 24 dec 2007, 16:07
Molecuulmodel vs atoommodel
Te weten wat men weet en te weten wat men niet weet, dat is kennis.
- Jan van de Velde
- Moderator
- Artikelen: 0
- Berichten: 51.334
- Lid geworden op: di 11 okt 2005, 20:46
Re: Molecuulmodel vs atoommodel
Ik weet met deze vraag, zo gesteld, eigenlijk ook zo gauw geen raad. Wat is het verschil tussen een cel en een plant?
Vooral ook omdat je het hebt over "het" molecuulmodel en "het" atoommodel.
Vooral ook omdat je het hebt over "het" molecuulmodel en "het" atoommodel.
ALS WIJ JE GEHOLPEN HEBBEN...
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
- Ruben01
- Artikelen: 0
- Berichten: 2.902
- Lid geworden op: wo 02 mei 2007, 18:10
Re: Molecuulmodel vs atoommodel
Welk atoommodel wil je juist vergelijken:
Kan je misschien een voorbeeld van een molecuulmodel geven (wat bedoel je daar juist mee). Persoonlijk ken ik geen molecuulmodel maar waarschijlijk is het gewoon de naam die ik nog nooit ben tegengekomen. Google kent ook niet echt veel molecuulmodellen.
- Bohr
- Rutherford
- Sommerfeld
- Schrödinger
- ...
Kan je misschien een voorbeeld van een molecuulmodel geven (wat bedoel je daar juist mee). Persoonlijk ken ik geen molecuulmodel maar waarschijlijk is het gewoon de naam die ik nog nooit ben tegengekomen. Google kent ook niet echt veel molecuulmodellen.
BOINC mee met het WSF-team: http://sciencetalk.nl/forum/index.ph ... opic=60653 http://sciencetalk.nl/forum/index.ph ... c=60653
- Elena
- Artikelen: 0
- Berichten: 77
- Lid geworden op: ma 24 dec 2007, 16:07
Re: Molecuulmodel vs atoommodel
Hai
alvast bedankt voor jullie snelle inzet voor het beantwoorden van mijn vraag !!!
ik zal even proberen duidelijker mijn ding proberen uit te leggen
MOLECUULMODEL
vb: H2O => H2 + O2
dan heb ik als tekeningetje daaronder
één bol => 2 bolletjes + 1 bolletje
ATOOMMODEL
dezelfde reactie met als tekening daaronder
2 keer één O-atoom met 2 H-atomen aanvast geplakt (zie link) => 4 H-atoompjes (4 bolletjes dus) + 2 O-atomen (2 bolletjes)
http://www.kta1-hasselt.be/content/project...tures/water.jpg
beetje duidelijke?
euhm ja weet ge, ik snap niet goed wat die 2 bolltjes H doen bij het molecuulmodel en hoe dat H2O-molecull opeens maar 1 bol is in het molecuulmodel en 2 delen in het atoommodel ...
kan je nog volgen?
anders probeer ik duidelijker te zijn
alvast bedankt voor jullie snelle inzet voor het beantwoorden van mijn vraag !!!
ik zal even proberen duidelijker mijn ding proberen uit te leggen
MOLECUULMODEL
vb: H2O => H2 + O2
dan heb ik als tekeningetje daaronder
één bol => 2 bolletjes + 1 bolletje
ATOOMMODEL
dezelfde reactie met als tekening daaronder
2 keer één O-atoom met 2 H-atomen aanvast geplakt (zie link) => 4 H-atoompjes (4 bolletjes dus) + 2 O-atomen (2 bolletjes)
http://www.kta1-hasselt.be/content/project...tures/water.jpg
beetje duidelijke?
euhm ja weet ge, ik snap niet goed wat die 2 bolltjes H doen bij het molecuulmodel en hoe dat H2O-molecull opeens maar 1 bol is in het molecuulmodel en 2 delen in het atoommodel ...
kan je nog volgen?
anders probeer ik duidelijker te zijn
Te weten wat men weet en te weten wat men niet weet, dat is kennis.
- PdeJongh
- Artikelen: 0
- Berichten: 2.005
- Lid geworden op: wo 06 dec 2006, 21:31
Re: Molecuulmodel vs atoommodel
Waarom teken je het watermolecuul als één bol?Elena schreef:MOLECUULMODEL
vb: H2O => H2 + O2
dan heb ik als tekeningetje daaronder
één bol => 2 bolletjes + 1 bolletje
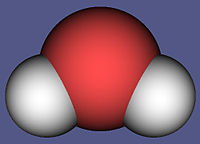
...verhit de dichloormono-oxide tot 277 graden Celcius en geniet van het effect...
- Ruben01
- Artikelen: 0
- Berichten: 2.902
- Lid geworden op: wo 02 mei 2007, 18:10
Re: Molecuulmodel vs atoommodel
Als ik de beschrijving van Elena probeer te ontcijferen dan is de onderstaande tekening (te danken aan PdeJongh) de voorstelling van het atoommodel (in jouw cursus).

Als ik water molecule intypt in google dan krijg ik op de engelstalige wikipedia de volgende tekening:
http://en.wikipedia.org/wiki/Image:Water_molecule_3D.svg
Persoonlijk zie ik niet veel verschil, blijkbaar spreken jouw cursus en andere bronnen elkaar een beetje tegen.
Misschien is er iemand die meer van chemie afweet en je vraag kan beantwoorden.

Als ik water molecule intypt in google dan krijg ik op de engelstalige wikipedia de volgende tekening:
http://en.wikipedia.org/wiki/Image:Water_molecule_3D.svg
Persoonlijk zie ik niet veel verschil, blijkbaar spreken jouw cursus en andere bronnen elkaar een beetje tegen.
Misschien is er iemand die meer van chemie afweet en je vraag kan beantwoorden.
BOINC mee met het WSF-team: http://sciencetalk.nl/forum/index.ph ... opic=60653 http://sciencetalk.nl/forum/index.ph ... c=60653
- Marko
- Artikelen: 0
- Berichten: 10.611
- Lid geworden op: vr 03 nov 2006, 23:08
Re: Molecuulmodel vs atoommodel
Ik weet ook niet zo goed wat ik hiermee aanmoet. Je kunt zeggen dat een molecuulmodel stelt dat iedere stof uit een groot aantal moleculen bestaat, die kunnen reageren en andere moleculen kunnen vormen. Die moleculen reageren in vaste verhoudingen, bijvoorbeeld 2 water --> 2 waterstof + 1 zuurstof.
Dat model beschrijft verder niet of die moleculen nog ergens anders uit bestaan.
Je kunt ook zeggen dat iedere stof uit een groot aantal atomen bestaat, die in een bepaalde verhouding in die stof voorkomen. Bij een chemische reactie kunnen die atomen zich anders rangschikken, en 2 nieuwe stoffen maken met andere verhoudingen van atomen erin. De atomen zelf zijn echter niet veranderd, alleen de manier waarop ze bij elkaar zitten.
De reactie wordt dan:
H2O --> 2 H + O
Oftewel: een stof die uit H en O bestaat in de verhouding 2:1 reageert tot 2 verschillende stoffen, een bestaat volledig uit H, een volledig uit O. Er ontstaat 2 keer zoveel van de eerste stof.
Dat model beschrijft verder niet of die moleculen nog ergens anders uit bestaan.
Je kunt ook zeggen dat iedere stof uit een groot aantal atomen bestaat, die in een bepaalde verhouding in die stof voorkomen. Bij een chemische reactie kunnen die atomen zich anders rangschikken, en 2 nieuwe stoffen maken met andere verhoudingen van atomen erin. De atomen zelf zijn echter niet veranderd, alleen de manier waarop ze bij elkaar zitten.
De reactie wordt dan:
H2O --> 2 H + O
Oftewel: een stof die uit H en O bestaat in de verhouding 2:1 reageert tot 2 verschillende stoffen, een bestaat volledig uit H, een volledig uit O. Er ontstaat 2 keer zoveel van de eerste stof.
Cetero censeo Senseo non esse bibendum
- Phys
- Artikelen: 0
- Berichten: 7.556
- Lid geworden op: za 23 sep 2006, 19:43
Re: Molecuulmodel vs atoommodel
De vraag lijkt te impliceren dat de twee 'modellen' twee verschillende beschrijvingen van hetzelfde fenomeen zijn. Maar het tegengestelde is eigenlijk waar: de enige overeenkomst tussen moleculen en atomen is dat het beide 'bouwstenen' van materie zijn, waarbij moleculen zijn opgebouwd uit atomen.
(zeg ik als scheikunde-leek)
(zeg ik als scheikunde-leek)
Never express yourself more clearly than you think.
- Niels Bohr -
- Niels Bohr -
- Elena
- Artikelen: 0
- Berichten: 77
- Lid geworden op: ma 24 dec 2007, 16:07
Re: Molecuulmodel vs atoommodel
Als ik de beschrijving van Elena probeer te ontcijferen dan is de onderstaande tekening (te danken aan PdeJongh) de voorstelling van het atoommodel (in jouw cursus).
=> inderdaad, dit is het atoommodel
maar zoals iemand al zei: bij het molecuulmodel is water als één bol getekend ... :s
(die afbeelding van jullie is inderdaad veel duidelijker, maar het gaat om het principe dat de ene keer water voorgesteld wordt als één bol, dan bij het andere model als een o-atoom met 2 H's aan ...)
ik dank jullie voor jullie uitleg, moet nog even zien wat ik nu het best kan onthouden
bedankt !
elena
=> inderdaad, dit is het atoommodel
maar zoals iemand al zei: bij het molecuulmodel is water als één bol getekend ... :s
(die afbeelding van jullie is inderdaad veel duidelijker, maar het gaat om het principe dat de ene keer water voorgesteld wordt als één bol, dan bij het andere model als een o-atoom met 2 H's aan ...)
ik dank jullie voor jullie uitleg, moet nog even zien wat ik nu het best kan onthouden
bedankt !
elena
Te weten wat men weet en te weten wat men niet weet, dat is kennis.
- Jan van de Velde
- Moderator
- Artikelen: 0
- Berichten: 51.334
- Lid geworden op: di 11 okt 2005, 20:46
Re: Molecuulmodel vs atoommodel
ik begin nou trouwens wel eens razend benieuwd te worden nar wat die cursus dan wel laat zien als molecuulmodel en atoommodel, en wat ze erover zegt. Want ik volg het nog steeds niet.
Kunnen relevante stukken hier eens geplaatst worden, als tekst en/of afbeelding ?
Kunnen relevante stukken hier eens geplaatst worden, als tekst en/of afbeelding ?
ALS WIJ JE GEHOLPEN HEBBEN...
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
help ons dan eiwitten vouwen, en help mee ziekten als kanker en zo te bestrijden in de vrije tijd van je chip...
http://sciencetalk.nl/forumshowtopic=59270
- thermo1945
- Artikelen: 0
- Berichten: 3.112
- Lid geworden op: ma 02 apr 2007, 23:29
Re: Molecuulmodel vs atoommodel
Moleculen zijn opgebouwd uit atomen.
In een molecuulmodel gaat het om welke atomen aan elkaar hechten en hoe de hechting tot stand komt.
Een atoommodel beschrijft het inwendige van een atoom.
In een molecuulmodel gaat het om welke atomen aan elkaar hechten en hoe de hechting tot stand komt.
Een atoommodel beschrijft het inwendige van een atoom.
- Marko
- Artikelen: 0
- Berichten: 10.611
- Lid geworden op: vr 03 nov 2006, 23:08
Re: Molecuulmodel vs atoommodel
Dat is ook een mogelijkheid, maar gezien de opmerking dat een watermolecuul wordt voorgesteld als 1 bol, denk ik toch meer in de richting van de verschillende modellen die er door de geschiedenis heen bestaan hebben als verklaring voor de opbouw van de materie. Op dit moment is ons model dat stoffen zijn opgebouwd uit moleculen, en dat de moleculen uit atomen bestaan, maar dat is niet altijd zo geweest...
Een groot deel van het gedrag van stoffen is verklaarbaar zonder aan te hoeven nemen dat moleculen uit atomen bestaan. Sterker, door moleculen te beschouwen als bollen met een bepaalde straal is onder andere de algemene gaswet af te leiden, viscositeit van oplossingen, etc.
Maar wat er werkelijk bedoeld werd is gissen, totdat we, zoals Jan al zei, de relevante stukken onder ogen krijgen
Een groot deel van het gedrag van stoffen is verklaarbaar zonder aan te hoeven nemen dat moleculen uit atomen bestaan. Sterker, door moleculen te beschouwen als bollen met een bepaalde straal is onder andere de algemene gaswet af te leiden, viscositeit van oplossingen, etc.
Maar wat er werkelijk bedoeld werd is gissen, totdat we, zoals Jan al zei, de relevante stukken onder ogen krijgen
Cetero censeo Senseo non esse bibendum
- Elena
- Artikelen: 0
- Berichten: 77
- Lid geworden op: ma 24 dec 2007, 16:07
Re: Molecuulmodel vs atoommodel
Ik denk dat Marko een beetje begint te snappen wat ik bedoel pi.gif
Ik heb een pagina uit men cursus even gescand en zet het in de bijlage ...
Eigenlijk heb ik hier niet echt stukken tekst van, onze docent zette dit op het bord, ik noteerde dit in mijn cursus, maar nu ik het aan het studeren kwam wist ik niet meer echt wat hij bedoelde, en om mijn docent nu om elke pruts te gaan emailen .... heb ik ninet echt veel zin in !
NOTA
met SZS bedoel ik samengestelde zuivere stoffen
met EZS bedoel ik enkelvoudige zuivere stoffen
onderaan staat het molecuulmodel afgebeeld zoals ik het bedoelde
boven SZS en EZS staat het atoommodel
sorry voor de kwaliteit!
Ik heb een pagina uit men cursus even gescand en zet het in de bijlage ...
Eigenlijk heb ik hier niet echt stukken tekst van, onze docent zette dit op het bord, ik noteerde dit in mijn cursus, maar nu ik het aan het studeren kwam wist ik niet meer echt wat hij bedoelde, en om mijn docent nu om elke pruts te gaan emailen .... heb ik ninet echt veel zin in !
NOTA
met SZS bedoel ik samengestelde zuivere stoffen
met EZS bedoel ik enkelvoudige zuivere stoffen
onderaan staat het molecuulmodel afgebeeld zoals ik het bedoelde
boven SZS en EZS staat het atoommodel
sorry voor de kwaliteit!
- Bijlagen
-
- img006 2174 keer bekeken
Te weten wat men weet en te weten wat men niet weet, dat is kennis.
- Elena
- Artikelen: 0
- Berichten: 77
- Lid geworden op: ma 24 dec 2007, 16:07
Re: Molecuulmodel vs atoommodel
5.4. Verfijning van het molecuulmodel: atoomtheorie
Voor de verklaring van chemische reacties zoals ontleding en synthese lijkt het molecuulmodel niet veel nieuws te brengen. Immers, hoe kunnen in een chemische reactie uit één stof twee andere stoffen (en dus ook twee andere moleculen) ontstaan, zoals gebeurt bij een ontledingsreactie?
Hoe kan men een ontbinding van een samengestelde stof voorstellen? Om chemische reacties te verklaren lijkt het nodig het molecuulmodel te verfijnen.
Uit het voorgaande kan afgeleid worden dat samengestelde stoffen een complexere inwendige bouw bezitten dan de enkelvoudige stoffen. De moleculen van de samengestelde stof moeten bouwsteentjes bevatten van alle enkelvoudige stoffen waaruit ze door synthese verkregen wordt.
synthese
enkelvoudige stof1 + enkelvoudige stof2 samengestelde stof
analyse
Het aantal bekende soorten enkelvoudige stoffen is beperkt tot een 200-tal. Daarentegen zijn er miljoenen soorten samengestelde stoffen.
Blijkbaar wordt zo een samengestelde stof opgebouwd uit een beperkt aantal bouwsteentjes: atomen.
Moleculen zijn opgebouwd uit atomen.
Enkelvoudige zuivere stoffen zijn opgebouwd uit gelijksoortige atomen. Samengestelde stoffen zijn opgebouwd uit verschillende soorten atomen.
In een molecule worden de atomen in een bepaalde aantalverhouding door een chemische band bij elkaar gehouden. De gevormde atoomcombinatie (molecule) vertoont sterk verschillende eigenschappen t.o.v. de afzonderlijke atomen.
In een molecule verliezen bijgevolg atomen hun individuele eigenschappen.
In een chemische reactie worden de uitgangsstoffen (reagentia) omgezet in andere stoffen (reactieproducten). Samengestelde stoffen kunnen ontleed worden in ten minste twee enkelvoudige stoffen. Enkelvoudige stoffen daarentegen zijn niet meer te ontleden in andere stoffen.
De kenmerken van een samengestelde stof verschillen sterk van die van de enkelvoudige stof, waarin ze kan ontleed worden.
Verklaring via het atoommodel
De moleculen van de reagerende stoffen worden omgevormd tot moleculen van de reactieproducten. De moleculen van een enkelvoudige stof bestaan uit atomen van eenzelfde soort. In een molecule worden de atomen in een welbepaalde aantalverhouding door een chemische band bij elkaar gehouden.. Hierdoor verliezen de atomen hun individuele eigenschappen.
Dit is nog een deeltje uit de cursus
Voor de verklaring van chemische reacties zoals ontleding en synthese lijkt het molecuulmodel niet veel nieuws te brengen. Immers, hoe kunnen in een chemische reactie uit één stof twee andere stoffen (en dus ook twee andere moleculen) ontstaan, zoals gebeurt bij een ontledingsreactie?
Hoe kan men een ontbinding van een samengestelde stof voorstellen? Om chemische reacties te verklaren lijkt het nodig het molecuulmodel te verfijnen.
Uit het voorgaande kan afgeleid worden dat samengestelde stoffen een complexere inwendige bouw bezitten dan de enkelvoudige stoffen. De moleculen van de samengestelde stof moeten bouwsteentjes bevatten van alle enkelvoudige stoffen waaruit ze door synthese verkregen wordt.
synthese
enkelvoudige stof1 + enkelvoudige stof2 samengestelde stof
analyse
Het aantal bekende soorten enkelvoudige stoffen is beperkt tot een 200-tal. Daarentegen zijn er miljoenen soorten samengestelde stoffen.
Blijkbaar wordt zo een samengestelde stof opgebouwd uit een beperkt aantal bouwsteentjes: atomen.
Moleculen zijn opgebouwd uit atomen.
Enkelvoudige zuivere stoffen zijn opgebouwd uit gelijksoortige atomen. Samengestelde stoffen zijn opgebouwd uit verschillende soorten atomen.
In een molecule worden de atomen in een bepaalde aantalverhouding door een chemische band bij elkaar gehouden. De gevormde atoomcombinatie (molecule) vertoont sterk verschillende eigenschappen t.o.v. de afzonderlijke atomen.
In een molecule verliezen bijgevolg atomen hun individuele eigenschappen.
In een chemische reactie worden de uitgangsstoffen (reagentia) omgezet in andere stoffen (reactieproducten). Samengestelde stoffen kunnen ontleed worden in ten minste twee enkelvoudige stoffen. Enkelvoudige stoffen daarentegen zijn niet meer te ontleden in andere stoffen.
De kenmerken van een samengestelde stof verschillen sterk van die van de enkelvoudige stof, waarin ze kan ontleed worden.
Verklaring via het atoommodel
De moleculen van de reagerende stoffen worden omgevormd tot moleculen van de reactieproducten. De moleculen van een enkelvoudige stof bestaan uit atomen van eenzelfde soort. In een molecule worden de atomen in een welbepaalde aantalverhouding door een chemische band bij elkaar gehouden.. Hierdoor verliezen de atomen hun individuele eigenschappen.
Dit is nog een deeltje uit de cursus
Te weten wat men weet en te weten wat men niet weet, dat is kennis.
- Marko
- Artikelen: 0
- Berichten: 10.611
- Lid geworden op: vr 03 nov 2006, 23:08
Re: Molecuulmodel vs atoommodel
De cursus komt sterk overeen met hoe het de eerste lessen scheikunde op de middelbare school werd uitgelegd.
Een opmerking bij je aantekeningen:
Als je de ontledingsreactie
water --> waterstof + zuurstof
bekijkt, dan zie je dat de stoffen reageren in de verhouding
2 water --> 2 waterstof + zuurstof
Maar je tekening, onderaan de pagina, laat zien:
1 water --> 2 waterstof + zuurstof
Je zou het verschil tussen het molecuulmodel en het atoommodel (althans, degene die hier bedoeld wordt) zo kunnen verwoorden:
Het molecuulmodel stelt:
Alle stoffen bestaan uit moleculen. De stoffen bestaan uit een groot, maar wel eindig aantal kleine deeltjes; je kunt dus bijvoorbeeld niet oneindig lang doorgaan met een stof in stukjes snijden. Bij zuivere stoffen zijn alle deeltjes hetzelfde. Moleculen kunnen met elkaar anderen moleculen vormen.
Er wordt niet ingegaan op de interne structuur van moleculen.
Het atoommodel gaat wat dieper op de zaak in; daar worden moleculen beschouwd als deeltjes die zijn opgebouwd uit atomen. Die atomen kun je van elkaar loshalen en op een andere manier aan elkaar zetten; dat is wat er bij chemische reacties gebeurt. De atomen zelf veranderen hierbij niet.
Het fundamentele verschil is dat vanuit het molecuulmodel bekeken, de bouwsteentjes kunnen veranderen; de water-bouwsteentjes kunnen veranderen in waterstof- en zuurstof-bouwsteentjes.
Het atoommodel stelt dat de bouwstenen onveranderlijk zijn. Je kunt van waterstof geen zuurstof maken. Wel kun je zorgen dat ze op een andere manier aan elkaar gaan zitten.
Wat dat laatste betreft moeten we nog een of 2 (of misschien wel meer!) niveaus dieper in de materie duiken om echt onveranderlijke deeltjes te hebben. We weten inmiddels dat atomen uit bouwstenen bestaan, die op hun beurt ook weer zijn opgebouwd uit andere bouwstenen.
Voor chemische reacties echter is het voldoende om atomen als ondeelbare en onveranderlijke deeltjes te beschouwen.
Nog een algemene opmerking erbij: Zowel in het geval van het (simpele) molecuulmodel als het meer uitgebreide atoommodel betreft het een model, een beschrijving van de werkelijkheid. Met moderne apparatuur is het redelijk goed mogelijk om moleculen en zelfs atomen te "zien". Het is dan ook algemeen aanvaard dat het atoommodel klopt. Dat is lange tijd niet zo geweest; moleculen en atomen waren in feite puur theoretische eenheden, en er waren fikse discussies over hun aard.
De eerste harde bewijzen dat moleculen inderdaad zijn opgebouwd uit atomen, en hoe dat er "uitziet", kwamen in feite pas deze eeuw, na de ontdekking van röntgenstralen en de toepassing ervan in röntgendiffractie. Daarmee werd het mogelijk de driedimensionale structuur van moleculen te bepalen, inclusief alle afstanden en hoeken tussen de atomen.
Een opmerking bij je aantekeningen:
Als je de ontledingsreactie
water --> waterstof + zuurstof
bekijkt, dan zie je dat de stoffen reageren in de verhouding
2 water --> 2 waterstof + zuurstof
Maar je tekening, onderaan de pagina, laat zien:
1 water --> 2 waterstof + zuurstof
Je zou het verschil tussen het molecuulmodel en het atoommodel (althans, degene die hier bedoeld wordt) zo kunnen verwoorden:
Het molecuulmodel stelt:
Alle stoffen bestaan uit moleculen. De stoffen bestaan uit een groot, maar wel eindig aantal kleine deeltjes; je kunt dus bijvoorbeeld niet oneindig lang doorgaan met een stof in stukjes snijden. Bij zuivere stoffen zijn alle deeltjes hetzelfde. Moleculen kunnen met elkaar anderen moleculen vormen.
Er wordt niet ingegaan op de interne structuur van moleculen.
Het atoommodel gaat wat dieper op de zaak in; daar worden moleculen beschouwd als deeltjes die zijn opgebouwd uit atomen. Die atomen kun je van elkaar loshalen en op een andere manier aan elkaar zetten; dat is wat er bij chemische reacties gebeurt. De atomen zelf veranderen hierbij niet.
Het fundamentele verschil is dat vanuit het molecuulmodel bekeken, de bouwsteentjes kunnen veranderen; de water-bouwsteentjes kunnen veranderen in waterstof- en zuurstof-bouwsteentjes.
Het atoommodel stelt dat de bouwstenen onveranderlijk zijn. Je kunt van waterstof geen zuurstof maken. Wel kun je zorgen dat ze op een andere manier aan elkaar gaan zitten.
Wat dat laatste betreft moeten we nog een of 2 (of misschien wel meer!) niveaus dieper in de materie duiken om echt onveranderlijke deeltjes te hebben. We weten inmiddels dat atomen uit bouwstenen bestaan, die op hun beurt ook weer zijn opgebouwd uit andere bouwstenen.
Voor chemische reacties echter is het voldoende om atomen als ondeelbare en onveranderlijke deeltjes te beschouwen.
Nog een algemene opmerking erbij: Zowel in het geval van het (simpele) molecuulmodel als het meer uitgebreide atoommodel betreft het een model, een beschrijving van de werkelijkheid. Met moderne apparatuur is het redelijk goed mogelijk om moleculen en zelfs atomen te "zien". Het is dan ook algemeen aanvaard dat het atoommodel klopt. Dat is lange tijd niet zo geweest; moleculen en atomen waren in feite puur theoretische eenheden, en er waren fikse discussies over hun aard.
De eerste harde bewijzen dat moleculen inderdaad zijn opgebouwd uit atomen, en hoe dat er "uitziet", kwamen in feite pas deze eeuw, na de ontdekking van röntgenstralen en de toepassing ervan in röntgendiffractie. Daarmee werd het mogelijk de driedimensionale structuur van moleculen te bepalen, inclusief alle afstanden en hoeken tussen de atomen.
Cetero censeo Senseo non esse bibendum