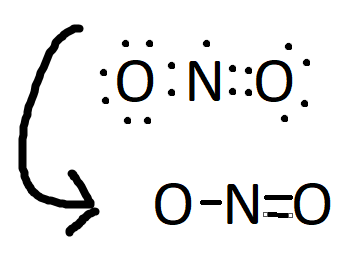remidepemie schreef:
Hoi,
Momenteel ben ik over lewisstructuren aan het leren en ik ben nu een beetje in de war. Ik kan de lewisstructuur van NO
2 maken, deze zal er zo uit zien en dit zou resulteren in deze structuurformule:
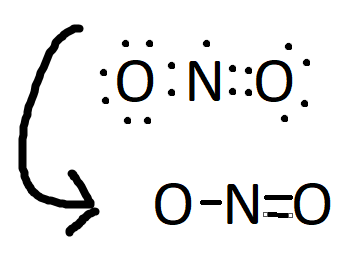
Wat ik mij nou afvraag is: wat gebeurd er met dat ene valentie elektron boven de stikstof?
Ook, zuurstof kan twee covalente bindingen maken daarom komt er in de structuurformule een minnetje boven de O met de enkele binding, toch?
Stikstofdioxide lijkt op deze manier niet echt stabiel... Aangezien NO
2 een gewoon gas is, kan het molecuul geen lading hebben toch?
Met dat valentie-elektron gebeurt niets. In NO
2 heeft het molecuul een ongepaard elektron, een radicaal.
Inderdaad kriijgt het O-atoom met de enkele binding een minlading. Niet per se omdat het een enkele binding heeft, maar als je gaat tellen, dan zie je dat het O-atoom 3 vrije elektronenparen heeft en 1 binding. De elektronen in die vrije elektronenparen heeft het O-atoom voor zichzelf, dat zijn dus in totaal 6 elektronen. De elektronen in de binding zijn gedeeld tussen N en O, dus het O-atoom heeft daar effectief 1 elektron van de 2. Totaal dus 7 elektronen, maar O heeft normaal 6 valentie-elektronen. Op deze manier dus 1 teveel, en daar komt de negatieve (formele) lading vandaan.
Op dezelfde manier kun je de formele lading van het andere O-atoom berekenen (nul), en van het N-atoom: 3 bindingen + 1 los elektron voor zichzelf. Totaal 4, één minder dan de 5 valentie-elektronen van N. Dus N heeft een formele lading van 1+.
De complete structuur ziet er dus zo uit:
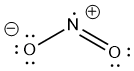
- NO2 8555 keer bekeken
Het molecuul heeft dus een formele lading van 1+ en van 1-, in totaal dus 0. In totaal is het molecuul dus ongeladen.
Maar dat is nog niet het hele verhaal. Je had net zo goed een structuur kunnen tekenen waar de dubbele binding links zit en de enkele binding rechts. Die 2 vormen zijn gelijkwaardig aan elkaar. In werkelijkheid zit er in NO
2 dus niet 1 dubbele en 1 enkele binding, maar 2 keer een "anderhalve" binding tussen N en de O's. Dit fenomeen heet resonantie en draagt bij aan de stabiliteit. Dit wordt weergegeven met een dubbele pijl.
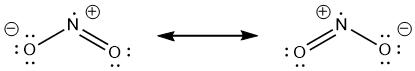
- NO2 resonantie 8555 keer bekeken
En dat is nog niet het hele verhaal, want dat ongepaarde elektron hoeft helemaal niet op N te zitten. Sterker nog, dat is helemaal niet zo "handig". Stel dat het N-atoom een elektron "leent" van het O-atoom met de minlading. Dan zijn ze ineens allebei neutraal:
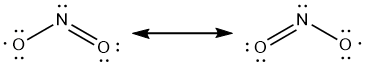
- NO2 resonantie 2 8556 keer bekeken
Het probleem van het ongepaarde elektron wordt verdeeld over het molecuul. Door deze stabilisatie kan het NO
2-molecuul bestaan. Het is niet heel stabiel en door het ongepaarde elektron behoorlijk reactief. Maar het kan bestaan, je kunt het meten, enzovoort.
Als er overigens genoeg andere NO
2 moleculen in de buurt zijn zullen die overigens met elkaar reageren tot N
2O
4. Dan zijn ze ook van het probleem van het ongepaarde elektron af.