In het huiswerkforum vind je een topic voor je vragen en opmerkingen over de cursus en/of de oefenopgaven.
Zit je met een opgave over molrekenen waar je niet aan uit geraakt? Open dan een topic in het huiswerkforum.
Er is ook een volledig overzicht van alle cursussen, FAQ's en handleidingen
----------------------------------------------------------------------------------------
Oefenopgaven bij de
[microcursus] Het begrip "MOL"
Het (kale) eindantwoord en de uitwerking vind je steeds door te klikken op de respectievelijke
Verborgen inhoud
Verborgen inhoud.
Let in de voorbeeldantwoorden niet op de significantie van de cijfers. Gezien de bedoeling van de oefeningen geven we het antwoord steeds in duidelijk herkenbare getallen.
Voor de berekeningen gebruiken we de gegevens uit deze tabel:

(bron:
Chemix - Periodic Table)
We ronden in deze oefenopgaven af op héle eenheden. Bijvoorbeeld:
- Voor de atoommassa van het zuurstofatoom (O) gebruiken we niet 15,99 u, maar 16 u;
- Voor de atoommassa van het ijzeratoom (Fe) gebruiken we niet 55,84 u, maar 56 u.
Voor het getal van Avogadro gebruiken we 6,022·10
23.
1 IJzeren balk
a) Een ijzeren T-profiel heeft een massa van 14,0 kg. Hoeveel mol ijzeratomen (Fe) zitten er in deze balk?
Antwoord:
-
Spoiler: [+]
- 250 mol
Uitwerking:
Verborgen inhoud
De massa van één ijzeratoom bedraagt 56 u. 1 mol ijzeratomen heeft dan een massa van 56 g, oftewel 0,056 kg.
Het T-profiel bevat dus 14 / 0,056 = 250 mol ijzeratomen.
b) Hoeveel ijzeratomen zijn dat eigenlijk als je het antwoord in losse atomen uitdrukt?
Antwoord:
-
Spoiler: [+]
- 1,5055·1026 losse atomen
Uitwerking:
Verborgen inhoud
De balk bevat 250 mol ijzeratomen. 1 mol ijzeratomen is gelijk aan 6,022·1023stuks.
250 mol is dus 250 x 6,022·1023 = 1 505,5·1023 = 1,5055·1026 ijzeratomen
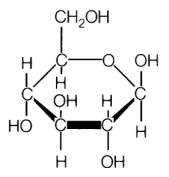
2 Het glucosemolecuul
Het glucosemolecuul heeft als brutomolecuulformule C
6H
12O
6
Wat is de massa van 1 molecuul glucose in de eenheid u?
Antwoord:
-
Spoiler: [+]
- 180 u
Uitwerking:
Verborgen inhoud
De atoommassa van koolstof ( C ) is 12 u.
De atoommassa van waterstof (H) is 1 u.
De atoommassa van zuurstof (O) is 16 u.
Een glucosemolecuul (C6H12O6) bestaat uit 6 atomen C , 12 atomen H en 6 atomen O.
De massa van een glucosemolecuul is dan ook (6 x 12) + (12 x 1) + (6 x 16) = 180 u
3 Slechts een druppeltje
Een druppel water (H
2O) heeft een massa van 0,04 g. Hoeveel watermoleculen zal dit druppeltje ongeveer bevatten?
Antwoord:
-
Spoiler: [+]
- 1 338 000 000 000 000 000 000 (1,338·1021) watermoleculen
Uitwerking:
Verborgen inhoud
1 H-atoom heeft een massa van 1 u, 1 mol H-atomen dus een massa van 1 g.
1 O-atoom heeft een massa van 16 u, 1 mol O-atomen dus een massa van 16 g.
Een molecuul water bestaat uit twee H-atomen en één O-atoom.
1 H2O-molecuul heeft dus een massa van (2x1)+(1x16) = 18 u, 1 mol watermoleculen dus een massa van 18 g.
De druppel heeft een massa van 0,04 g en bevat dus 0,04 (g) / 18 (g/mol) = 0,002222 mol watermoleculen.
1 mol water bevat 6,022·1023 moleculen.
0,002222 mol bevat dan 0,002222 x 6,022·1023 = 0,01338·1023 = 1 338 000 000 000 000 000 000 (1,338·1021) watermoleculen.
4 Het magnesiumgehalte van bitterzout
Bitterzout (Epsom salt) is de gehydrateerde vorm van magnesiumsulfaat. In het kristal bevinden zich voor elk magnesiumsulfaatmolecuul (MgSO
4) ook 10 watermoleculen (H
2O). Je schrijft dat als MgSO
4.10H
2O.
Hoeveel gram zuiver magnesium zou je uit 1 kg bitterzout kunnen halen?
Antwoord:
-
Spoiler: [+]
- 80 g
Uitwerking:
Verborgen inhoud
1 Mg-atoom heeft een massa van 24 u.
1 S-atoom heeft een massa van 32 u.
1 O-atoom heeft een massa van 16 u.
1 H-atoom heeft een massa van 1 u.
MgSO4 heeft een molecuulmassa van:
(1 x 24) + (1 x 32) + (4 x 16) = 120 u.
H2O heeft een molecuulmassa van:
(2 x 1) + (1 x 16) = 18 u.
MgSO4.10H2O bevat 10 watermoleculen, dat is dus 10 x 18 = 180 u.
Totale molecuulmassa voor MgSO4.10H2O is dan 120 + 180 = 300 u.
24 u daarvan is magnesium.
1 kg bitterzout bevat 24/300 x 1000 g = 80 g magnesium.
5 De massa van een kuub lucht
Lucht bestaat voor ongeveer 80 volume% uit stikstofgas (N
2) en voor 20 volume% uit zuurstofgas (O
2).
1 mol gasmoleculen neemt bij standaarddruk en 25°C een volume in van 24,5 L. Wat is onder deze omstandigheden de massa van 1 kubieke meter lucht?
Antwoord:
-
Spoiler: [+]
- 1175 g
Uitwerking:
Verborgen inhoud
1 N-atoom heeft een massa van 14 u, 1 mol N-atomen dus een massa van 14 g.
1 O-atoom heeft een massa van 16 u, 1 mol O-atomen dus een massa van 16 g.
Een molecuul stikstofgas bestaat uit twee N-atomen.
1 N2-molecuul heeft dus een massa van (2x14) = 28 u, 1 mol stikstofgasmoleculen dus een massa van 28 g.
Een molecuul zuurstofgas bestaat uit twee O-atomen
1 O2-molecuul heeft dus een massa van (2x16) = 32 u, 1 mol zuurstofgasmoleculen dus een massa van 32 g.
Lucht bevat 80 volume% N2. 1 m³ lucht bevat dus 800 L N2. Dat is 800 (L) / 24,5 (L/mol) = 32,65 mol N2.
De massa van 1 mol N2 is 28 g.
De massa van 32,65 mol is dan 32,65 (mol) x 28 (g/mol) = 914 g.
Lucht bevat 20 volume% O2. 1 m³ lucht bevat dus 200 L O2. Dat is 200 (L) / 24,5 (L/mol) = 8,16 mol O2.
De massa van 1 mol O2 is 32 g.
De massa van 8,16 mol is dan 8,16 (mol) x 32 (g/mol) = 261 g.
Samen is dat dus ongeveer 914 + 261 = 1175 g. (Dat is minder dan je in de meeste tabellenboeken vindt. Dat komt omdat in de meeste tabellenboeken de dichtheid van lucht wordt gegeven voor lucht van 0°C, en wij het hier voor lucht van 25°C berekenden)
6 De weerballon
Een
weerballon heeft op de grond een straal r van 2 m.
Neem aan dat de ballon bolvormig is.
We moeten deze vullen met heliumgas (He), dat bestaat uit losse heliumatomen.
1 mol heliumgas neemt bij standaarddruk een volume in van 24,5 L (vast gegeven bij standaarddruk en 25°C).
Het volume van een bol bereken je met de formule
\(\frac{4}{3}\pi r^3 \)
.
Hoeveel kilogram heliumgas moeten we kopen?
Antwoord:
-
Spoiler: [+]
- 5,471 kg He
Uitwerking:
Verborgen inhoudHet volume van de ballon is \(\frac{4}{3}\pi 2^3 \)
= 33,51 m³ = 33510 L.
1 mol gas neemt hier 24,5 L volume in. De ballon bevat dus 33510 / 24,5 = 1367,77 mol heliumgas.
Helium is een mono-atomair gas, de ballon zal dus ook 1367,77 mol He-atomen bevatten.
1 heliumatoom heeft een massa van 4 u, 1 mol heliumatomen dus een massa van 4 g.
De ballon bevat dus 1368 (mol) x 4 (g/mol) = 5 471 g = 5,471 kg helium.

 (1776 - 1856)
(1776 - 1856) (bron:
(bron: